Origine du Second Principe
Nous allons essayer de comprendre ici d'où vient exactement la tendance de l'univers à évoluer vers le désordre, en prenant comme exemple un billard d'un genre un peu particulier : un billard sur lequel les boules rouleraient sans être freinées. Une fois mises en mouvement, elles ne s'arrêteraient donc plus...Nous allons maintenant placer, comme dessiné ci-dessous, une plaque au milieu du billard, qui laisse néanmoins de l'espace pour que les boules puissent passer d'un côté à l'autre. On laisse évoluer six boules dans ce nouvel environnement, et on fait attention au côté de la plaque où elles se trouvent. On s'aperçoit qu'en fait, il est assez rare de les trouver toutes par hasard du même côté de la plaque. Et qu'en tous les cas, cette situation ne dure jamais très longtemps. La plupart du temps, on en a 3 d'un côté et 3 de l'autre. Nous pouvons donc dire qu'en moyenne, au cours du temps, les boules ne se mettent pas toutes seules du même côté de la plaque, mais qu'elles sont réparties.
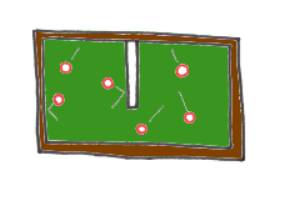
Maintenant, on vous dit qu'on a lancé vingt boules sur le billard, et qu'on a pris deux photos, l'une à l'instant initial, et l'autre un peu plus tard. On vous montre deux photos, l'une sur laquelle vous voyez autant de boules de chaque côté de la plaque, l'autre sur laquelle vous les voyez toutes d'un même côté. Et on vous demande laquelle représente l'instant initial, laquelle est prise plus tard. Comment répondre ?
Eh bien c'est simple : vous aurez beaucoup, beaucoup moins de chances de vous tromper si vous répondez que les boules ont d'abord été lancées toutes du même côté, et qu'elles se sont ensuite réparties. C'est ce qui est le plus probable, et de loin. Bien entendu, l'inverse n'est pas strictement impossible, mais il est tellement rare, que vous avez bien plus de chances d'avoir tout faux en supposant que les boules se sont spontanément rassemblées. Et avec 20 boules, il faut attendre longtemps, quand on les a lancées au hasard, avant de les voir toutes d'un même côté.
Donc finalement, on peut considérer qu'est apparu un phénomène presque irréversible : les boules ont bien tendance à se répartir, à augmenter leur désordre, si on les laisse à elles-mêmes. C'est simplement que c'est de beaucoup le plus probable. Vous savez dire quelle photo a été prise la première avec très peu de chances de vous tromper ! Les boules de billard obéissent donc au second principe de la thermodynamique, puisque leur désordre croît avec le temps !
En fait, les boules de billard ressemblent beaucoup à des molécules de gaz. Et un gaz, comme les boules de billard, a tendance à occuper toute la place qui lui est disponible, donc à maximiser son désordre. Si vous regardez un gaz dans une boîte, il ne va jamais spontanément se serrer dans un coin. Même si rien ne semble l'interdire vraiment. Sachez cependant que si avec 20 boules de billard, ça vous paraît déjà long d'attendre qu'elles soient d'un côté de la boîte, alors avec un gaz, ca va vous paraître encore plus long : même un centimètre cube de gaz contient plusieurs milliards de milliards de molécules. Au moins. Donc pour qu'elles se mettent toutes d'un côté de la boîte, et que le second principe soit violé, vous devrez attendre au moins plusieurs milliards d'années, sans même être sûr que cela puisse arriver en attendant assez longtemps. C'est extrêmement improbable.
Prenons maintenant l'exemple de deux cubes, un chaud et un froid, au contact l'un de l'autre. En moyenne, les particules chaudes, plus agitées, cognent contre les particules froides, et leur communiquent ainsi leur agitation, en en perdant. Donc l'agitation thermique a tendance à s'homogénéiser. C'est à dire que le cube froid et le cube chaud finiront par être tièdes tous les deux. Mais c'est là aussi une tendance purement statistique, car le comportement des particules de ces cubes, ne permet pas de dire que l'inverse est impossible. Il est possible, mais hautement improbable !
Si on considère une goutte de colorant dans de l'eau, on imagine que les particules de colorant subissent des chocs de la part des particules d'eau. Ces chocs aléatoires ont tendance à disperser le colorant. Mais là encore, par un hasard extraordinaire, tel que nul ne l'a jamais constaté et ne le constatera sans doute jamais, il se pourrait que le colorant se regroupe au lieu de se disperser. Rien ne l'interdit vraiment dans les lois fondamentales qui gouvernent les particules. Mais c'est tellement improbable qu'on peut considérer que c'est impossible. D'ailleurs, avant d'être expliqué ainsi, le second principe est un principe empirique, c'est à dire tiré de l'expérience - de ce que nous voyons autour de nous, en fait.
On dit donc que le second principe de la thermodynamique a une origine statistique.