Comment les atomes émettent de la lumière...
Un atome, c'est des électrons en orbite autour d'un noyau. Comment imaginer ça ? Bah, quelque part, ça ressemble à un système solaire en miniature : des électrons qui tournent autour du noyau, comme des planètes autour du soleil. La différence avec les planètes, c'est que les électrons ne peuvent pas avoir n'importe quelle "trajectoire" autour du noyau. Chacune des trajectoires permises est appellée orbitale. On peut imaginer des trajectoires circulaires autour du noyau, de rayons différents.
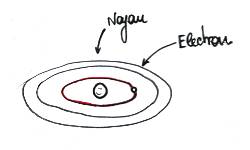
| Voici à quoi ressemble l'atome le plus simple : l'atome d'hydrogène. Il n'a qu'un seul électron. On a "dessiné" les orbites possibles de l'électron. Là, il est représenté sur l'orbitale la plus proche du noyau. L'atome est alors dans son état fondamental, son état de repos, si vous préférez. |
En temps normal, les électrons sont au plus près du noyau, sur les orbitales les plus basses. Un électron sur une orbite un peu plus haute que la normale est un électron qui possède une certaine énergie en réserve (une énergie potentielle). On dit que l'atome est excité. Pour qu'un électron puisse descendre vers une orbitale plus proche du noyau, il faut qu'il se débarrasse de son énergie. Inversement, pour qu'un électron s'éloigne du noyau en changeant d'orbitale, il faut qu'il reçoive de l'énergie. Il existe deux façons de faire.
-
Cela peut se faire simplement lorsqu'un atome se heurte à un autre
atome : ils peuvent échanger de l'énergie, dans le choc. Les
électrons peuvent alors changer d'orbitale à cette occasion.
Mais la façon qui nous intéresse ici, et qui est tout de même la plus importante, c'est de gagner ou de perdre de l'énergie sous forme de lumière. Car c'est possible : pour perdre de l'énergie, et descendre sur une orbitale plus basse, l'électron est capable d'émettre un photon, un grain de lumière. L'énergie transportée par le photon qui part est exactement celle que l'électron avait en trop. La couleur du photon est liée à son énergie : plus le photon est bleu, plus il transporte d'énergie. Plus il est rouge, moins il en transporte. Donc la couleur du photon émis par l'électron dépend de la différence d'énergie entre les deux orbitales.
Cette façon d'émettre de la lumière est une des deux façons possibles. L'autre, c'est celle qui est utilisée dans les lampes à incandescence (nos ampoules habituelles). Mais il existe des lampes qui utilisent la façon des atomes d'émettre de la lumière en se désexcitant. Ces lampes sont particulières : elles n'émettent que des couleurs particulières, qui correspondent à toutes les transitions possibles entre les orbitales. On les appelle des lampes spectrales....brrrrr ! Pour voir ces couleurs, il faut avoir un prisme, pour décomposer la lumière émise. Et c'est très net !